2005: Yves Chauvin; Robert Grubbs; Richard Schrock
„Za objav metód metatézy pre organickú syntézu“
Takže aj tento objav sa bude týkať organickej chémie. V minulom blogu som spomenul, že pre organického chemika je každá molekula takým vianočným stromčekom na ktorom sú gule, reťaze a sviečky - funkčné skupiny. Ale ťažko by sme mohli vešať nejaké ozdoby, ak by sme nemali pevnú jedličku – uhlíkatý skelet molekuly. Aby sme mohli efektívne syntetizovať hocijaké molekuly, na aké si len zmyslíme (alebo na aké dostaneme grantovú podporu), tak musíme mať efektívne metódy, aby sme vedeli zostrojiť ten uhlíkatý skelet – chrbtovú kosť našej molekuly. Metatéza (z gréčtiny: presunutie, prehodenie) je práve takouto metódou. Aby sme si mohli priblížiť, čo toto cudzie slovo vlastne znamená pre chemikov, tak musíme trochu zaspomínať na základoškolskú chémiu.
Nasleduje „chemické antré“ o tom, čo to je dvojitá väzba (ak si to pamätáte zo školy – tak kľudne preskočte odstavec). Na ZŠ sa spomína, že väzba medzi dvoma atómami sa vytvorí systémom: „ja ti podám ruku, ty mi podáš ruku – a chytíme sa spolu“. Každá z tých rúk reprezentuje jeden elektrón (odtiaľ ona poučka, že väzba sa tvorí zdieľaním 2 elektrónov). V organických zlúčeninách je pre nás najzaujímavejší uhlík – lebo ten tvorí kostru molekuly. Uhlík má k dispozícii 4 ruky ktorými môže niekoho chytiť (má štyri valenčné elektróny). Niektorých z vás isto napadlo, že v reálnom živote sa môžem chytiť druhého človeka dvoma rukami a pýtate sa, či to môže spraviť aj potvora uhlík. No jasne, že môže – a tak vzniká dvojitá väzba! Na obrázku dole môžete vidieť situácie ktoré môžu nastať (takto to kreslia organici – žiadne vodíky okolo – kreslí sa len uhlíkatá kostra)

Vo vrchnej molekule sú len uhlíky spojené jednoduchými väzbami – tie krajné sa držia len jedného kolegu, tie prostredné vždy dvoch. (mimochodom – toto v benzíne nechceme. Volá sa to oktán a má to oktánové číslo 0 J) Spodné dve molekuly obsahujú aj uhlíky, ktoré držia suseda dvoma rukami – obsahujú jednu dvojitú väzbu. Volajú sa alkény.
Toľko „antré“. A teraz, čo to je vlastne tá metatéza? Ako som už vyššie spomenul, metatéza znamená z gréčtiny niečo ako „prehodenie“. Pre nás to bude prehodenie - výmena partnerov, s ktorými sa atómy držia v molekule dvoma rukami. Chemici už dávnejšie vedeli, že ak sa zlúčeniny s dvojitými väzbami zahrejú na dostatočne vysokú teplotu (a najlepšie sa pri tom na nich ešte aj intenzívne svieti), tak tie atómy, ktoré sa držali kolegu dvoma rukami jednu z nich pustia a snažia sa nájsť si druhého parťáka s ktorým by zovreli pravicu. Ak ste sa niekedy hrali hru „gordický uzol“ (Ľudia zavrú oči, a poslepiačky chytia najbližšie ruky okolo. Keď otvoria oči, tak ich cieľom je rozpliesť pletenec, čo takto vznikol bez toho, aby sa pustili toho, koho držia...), tak asi viete, ako to dopadne – vzniká totálne nekontrolovateľná zmes s ktorou si možno ťažko poradiť. Navyše ak sa to s tým zohrievaním prehnalo, tak namiesto vábnych produktov vznikne len čierny asfalt...
Ale pánovi Grubbsovi a Schrockovi sa podarilo vymyslieť ako na to! Nekontrolovateľné párovanie partnerov – ako pri hre „gordický uzol“ vymenili za niečo, čo skôr pripomína spoločenský tanec, pri ktorom sa synchronizovane vymieňajú partneri. Zistili, že na to, aby takáto reakcia prebiehala, stačí pridať zlúčeninu ruténia (analógia s tancom – stačí aby to jeden začal „roztáčať“ a ostatní sa musia prispôsobiť). Na nasledovnom obrázku je vysvetlené ako to prebieha. Nedajte sa zmiasť zložitosťou – v skutočnosti sa nejedná o nič iné, než chemickú verziu rozjuchanej krčmovej polky, kde raz tancujete s tou, potom v kolečku, a hneď zas s inou!
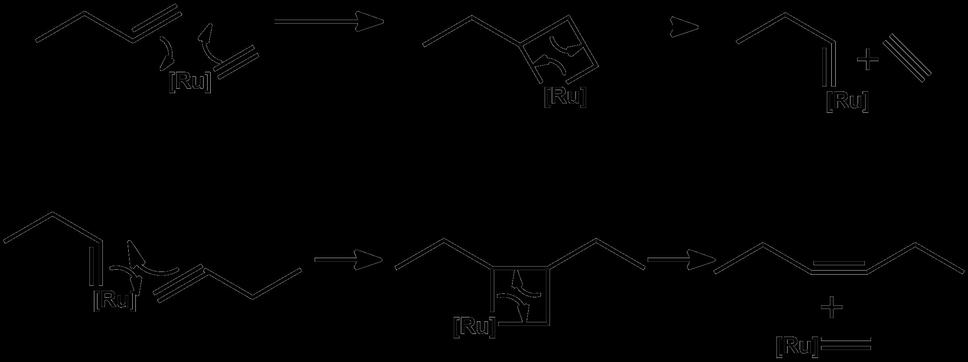
Najprv nám prichádza naša zlúčenina s dvojitou väzbou. Pristupuje k nej ruténium – ktoré tiež drží jeden uhlík dvoma rukami. Dve šípky nám udávajú kto sa koho chytí – jeden uhlík z alkénu sa chytí ruténia. To zasa pustí jednou rukou svoj uhlík a chytí sa druhého uhlíku z alkénu. Vytvoria tak „kolečko“ – štvorčlenný kruh. Po chvíli sa znova dvaja partneri pustia a chytia sa toho na opačnej strane – kruh sa ruší a dostaneme znovu jednu zlúčeninu s ruténiom a jeden alkén (etylén). To sa udialo v prvom riadku. Celá paráda sa môže zopakovať s ďalšou molekulou alkénu – to je popísané v druhom riadku. Na konci dostávame jednoduchú zlúčeninu ruténia a zložitý alkén.
V čom je krása tejto reakcie? Tak najprv – ruténium z nej nakoniec vychádza v rovnakej forme v akej do nej vošlo – takže sa v reakcii nespotrebováva. Je to katalyzátor. Za druhé - z mechanizmu (priebehu) reakcie je jasné aké produkty dostaneme – nemôže vzniknúť nič iné. Za tretie – celá reakcia by mohla bežať aj opačným smerom – keby sa nám zachcelo vyrábať jednoduché alkény zo zložitejšieho. Vďaka týmto vlastnostiam sa metatéza často využíva pri totálnej syntéze. Totálna syntéza je pre niektorých chemikov niečo ako svätý grál – celé to spočíva v tom, že chemici „uvaria“ nejakú strašne zložitú molekulu (ktorá je obvykle známa z prírody – napríklad antibiotikum) z komerčne dostupných látok. Metatéza nám umožnila syntetizovať šialene zložité látky, na aké sme doteraz ani nepomysleli. (pre otrlých – skúste na obrázku nájsť, kde prebehla metatéza. Ak ste hľadali správne, tak vidíte že sa pomocou metatézy dá uzavrieť nový kruh.)
Tak a teraz tie sľubované aplikácie v bežnom živote. Na začiatku som spomínal, že metatéza nám umožňuje využiť odpady z rafinérií a tiež výrobu „eko“ saponátov. Ide o to, že aj pri výrobe „eko“ saponátov nám vzniká veľké množstvo odpadu – dlhých alkénov, ktoré majú dvojitú väzbu schovanú niekde v strede molekuly. Ak by sme nevedeli takéto odpady rozumne využiť, tak by veru výroba moc „eko“ nebola... Ale metatéza nám umožňuje presne to, čo potrebujeme – rozsekne dlhé reťazce v strede, na mieste dvojitej väzby – dostaneme tak alkény ktoré môžeme vrátiť späť do výroby saponátov. Podobný trik (vnútorná recyklácia v rámci výroby) sa mimochodom v priemysle často používa. Ďalším zaujímavým využitím metatézy je výroba špecializovaných polymérov – napríklad neoprénov na potápanie, alebo aj polymérov, ktoré dokážu absorbovať náraz (čo asi nie je zlý materiál na výrobu nárazníkov J ).
No a nakoniec tie intrigy a špekulácie... Cena ruténia nie je malá – pohybuje sa okolo 50 – 100 dolárov za uncu. Pri takejto cene je možné využívať ho v priemysle na výroby, ktoré som spomenul. Od 90-tych rokov sa postupne začalo objavovať čím daľej tým viac tovární, kde sa používa metatéza - a ruténium. Cena vďaka tomu mierne kolísala. Ale v roku 2007 cena vystrelila až na 900 dolárov za uncu! Továrnikov mohol trafiť šľak – lebo s tým prirodzene nikto nepočítal. Zopár tovární vďaka tomu aj kľaklo (a investori pochopili, prečo sa to volalo rizikový kapitál). Čo sa vlastne stalo?
Za toto rošambo môžeme poďakovať výrobcom pevných diskov. V roku 2006 sa zaviedla nová metóda výroby ich povrchov, kde sa využíva ruténium. Využíva sa onen trik, čo som už spomenul – vnútorná recyklácia v rámci výroby. Tá dosahovala viac ako 99%. To znamená, že na 1 g ruténia, čo sa nanesie na pevný disk sa spotrebuje 100 g, z ktorých nakoniec 99 g recyklujeme nazad. Problémom je, že počet firiem na svete, ktoré vyrábajú pevné disky by človek spočítal na prstoch jednej ruky. Neprekvapí preto, že všetky začali zavádzať novú technológiu naraz (dalo by sa zmieniť o účinnej priemyselnej špionáži). Na začiatok potrebovali ohromné množstvo ruténia – a nekupovali ho po častiach. Jedného krásneho dňa v roku 2007 proste prestal existovať trh s ruténiom. Včera bolo – dnes už nie. To vyvolalo paniku, ba aj bankroty niektorých malých chemických firiem. Za rok ale bolo už všetko v poriadku – výrobcovia pevných diskov ruténium predsa recyklujú – preto ho už v takom veľkom objeme nenakupujú. Cena spadla späť na úrovne spred roku 2007. Továrnici si vydýchli a špekulanti znovu utreli hubu. Podobných prekvapení sa však môžeme dočkať aj u iných vzácnych kovov, ak sa nájde nejaká nová technológia, ktorá ich bude využívať...






