Hoci genetická výbava buniek nášho tela je (takmer) identická, v jednotlivých tkanivách, v rôznych štádiách vývoja, resp. za rôznych podmienok života sa exprimujú, čiže prekladajú do konečných produktov (proteínov alebo tzv. funkčných RNA), iba určité gény. Medzi veľké množstvo spôsobov, ktorými bunky regulujú načasovanie a mieru expresie, patrí aj tzv. RNA interferencia. Tento proces dokáže bunku chrániť po napadnutí niektorými vírusmi, čo sa pôvodne pokladalo za jeho hlavnú úlohu. Postupne vedci odhalili mnohoraké funkcie RNA interferencie aj v zdravých bunkách; nevyhnutná je v diferenciácii, riadení vývoja organizmu, ba dokonca podmieňuje napríklad i rast a vetvenie dentritov v dospelom hipokampe. Jej zmeny sa však môžu podieľať aj na patogenéze rakoviny, stala sa preto ďalším potenciálnym terapeutickým terčom. V apríli 2010 publikoval tím amerických vedcov nádejné výsledky potvrdzujúce výrazné potlačenie tvorby metastáz využitím moderných inhibítorov RNA interferencie - antagomirov.
RNA interferencia - zásah do génovej expresie
Expresia génov začína ich prepisom z DNA do molekúl mediátorovej ("sprostredkujúcej") RNA (mRNA), ktoré sú po "kontrole správnosti" a určitých chemických modifikáciách prenesené z jadra bunky do cytoplazmy, kde na ne nasadajú ribozómy (obr. 1). Tieto zložité komplexy bielkovín a ribozomálnej RNA prekladajú sekvenciu mRNA do sekvencie aminokyselín, teda syntetizujú proteíny (bielkoviny).

Obr. 1: Expresia génu kódujúceho bielkovinu zahŕňa kroky od prepisu génu
z DNA po preklad na ribozómoch a regulovaná je na niekoľkých stupňoch.
Aby množstvo jednotlivých molekúl bolo rýchlo prispôsobiteľné aktuálnym potrebám bunky, vyvinuli sa počas evolúcie rôzne formy zásahu do jednotlivých úrovní expresie génu - od samotnej dostupnosti DNA pre prepisovaciu mašinériu, cez prepis do mRNA, jej transport z jadra, väzbu na ribozómy, tvorbu proteínu, až po rýchly rozklad mRNA.
RNA interferencia je zložitý proces (obr. 2) začínajúci prepisom špecifických úsekov DNA do RNA molekúl, z ktorých následne vznikajú tzv. mikroRNA (miRNA). Tieto, na rozdiel od mRNA, nekódujú proteíny, ale (po ďalších úpravách) zabezpečujú reguláciu expresie príslušných génov. miRNA naviazané na špecifický proteínový komplex RISC sa párujú s úsekmi mRNA obsahujúcimi k nim komplementárnu sekvenciu (zväčšený výsek na obr. 3). Komplementarita nemusí byť úplná, teda jedna miRNA sa môže byť schopná viazať na viacero čiastočne podobných mRNA, kódujúcich rôzne proteíny. Ak sú komplementárne úseky dostatočne dlhé, takto naviazaná mRNA je enzýmovo rozložená, teda nedôjde k jej prekladu do proteínu. Ak sú úseky krátke, výsledkom je iba destabilizácia mRNA a o jej prípadnom rozklade rozhodnú ďalšie faktory, čím sa rozširujú možnosti regulácie.
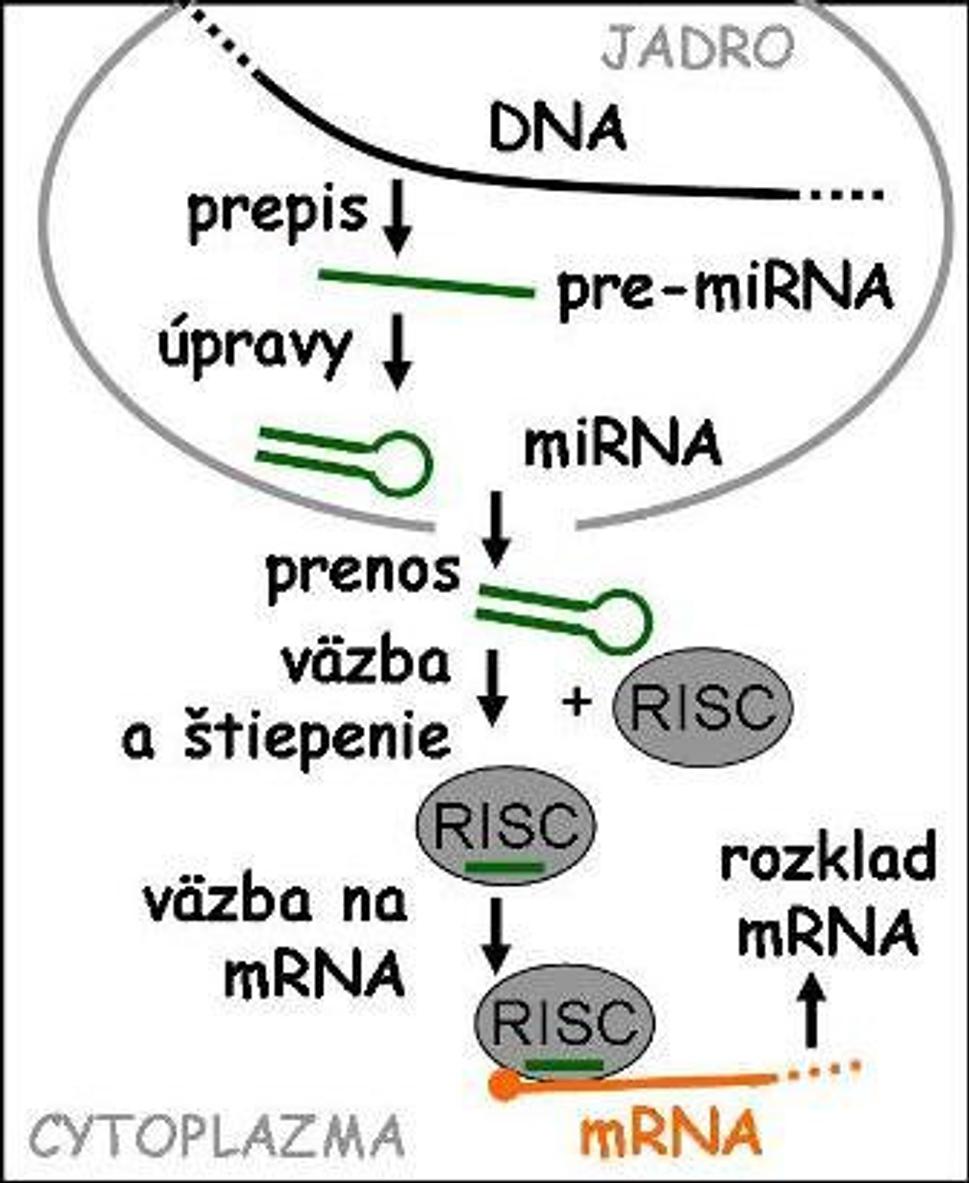
Obr. 2.: RNA interferencia je jedným z procesov regulácie na úrovni mRNA.
Zúčastňujú sa jej mikroRNA a proteínové komplexy (ako RISC)
a vedie zväčša k rozkladu cieľovej RNA, čím zabráni jej prekladu do proteínu.
V súčasnosti je v ľudských bunkách známych vyše 400 rôznych miRNA. Odhaduje sa, že regulujú aspoň tretinu génov kódujúcich proteíny. Komplexy zúčastnené v tomto procese, napr. RISC, slúžia zároveň v mechanizme obrany proti vírusom, ktorých genetická informácia je uložená v molekule RNA (napr. retrovírusy). Bunka spracuje dvojvláknový genóm RNA vírusu na kúsky podobné miRNA, nazývané však v tomto prípade malé interferujúce RNA (small interfering, siRNA). SiRNA, podobne ako miRNA, môžu v spojení s RISC-om viesť k rozkladu vírusových RNA. Viazané na iný proteínový komplex, RITS, dokážu dokonca utlmiť prepis tých vírusových génov, ktoré sa už stihli včleniť do hostiteľskej DNA.
Antagomiry - špecifické inhibítory miRNA
Detailné pochopenie jednotlivých bunkových procesov prináša neraz inšpirácie k novým prístupom v boji proti rozličným ochoreniam. RNA interferencia inšpirovala vedcov nie len svojou účinnosťou proti vírusom. Okrem toho, že sa stala nenahraditeľným nástrojom vo výskume, umožňujúcim dovtedy nemysliteľné testovanie dôsledkov čiastočného útlmu expresie jednotlivých génov, otvorila aj celkom nové možnosti diagnostiky, liečby a prognózy jej účinnosti.
Vedci v postihnutých bunkách nachádzajú miRNA využiteľné ako špecifické markery inak ťažko diagonostikovateľných typov nádorov. Množstvá určitých miRNA im už v niektorých prípadoch umožňujú predpovedať vývoj choroby. V neposlednom rade do buniek pokusne vnášajú umelé siRNA utlmujúce vznik proteínov, ktoré napomáhajú patogenéze rakoviny, neurodegeneratívnych či iných chorôb.
Opačným prístupom je inhibícia nežiaducej RNA interferencie. Čím možno špecificky zablokovať konkrétnu miRNA? Špecificita účinku akéhokoľvek liečiva spočíva v tom, že svojím tvarom zapadá do štruktúry cieľovej molekuly, podobne ako kľúč do zámky. Zatiaľ čo ak je cieľom bielkovina, dizajn inhibítora je komplikovaný zložitosťou jej 3D štruktúry, v prípade RNA sú obrovskou výhodou pravidlá komplementarity, podľa ktorých sa viažu na iné RNA. Molekulou špecificky sa viažucou na miRNA, a tým blokujúcou jej funkciu, je práve k nej komplementárna RNA.
Pripraviť molekuly RNA so želanou sekvenciou je dnes jednoduché. Problémom pri akejkoľvek práci s RNA je ale všadeprítomnosť enzýmov, ktoré ju rozkladajú (ribonulkeáz), teda ani jej prípadné úspešné vnesenie do bunky nie je ešte výhrou. Našťastie chémia poskytuje možnosti modifikácií molekúl RNA zvyšujúcich jej stabilitu, bez vplyvu na komplementaritu. Využívané chemické zmeny zahŕňajú, okrem rôznych derivácií stavebných prvkov RNA, náhradu fosfodiesterových väzieb v jej základnej "kostre" fosfotioesterovými ("náhrada kyslíku sírou"), ktoré ribonukleázy rozštiepiť nedokážu. Takéto deriváty RNA pripravil tím M. Stoffela už v roku 2005 a vo svojom článku v časopise Nature pre ne zaviedli termín antagomiry. Pohyb antagomiru po organizme a jeho vstup do bunky zabezpečuje na jeho konci naviazaná molekula cholesterolu.
Antagomiry v boji proti metastázam
Až 90 % úmrtí na rakovinu je spôsobených metastázami, čiže sekundárnymi nádormi utvorenými z buniek, ktoré sa uvoľnili z pôvodného ložiska a usadili sa vo vzdialených častiach tela. Zatiaľ čo primárny nádor je zväčša chirurgicky odstrániteľný a vznik ďalšieho z jeho prípadných zvyškov sa dá potlačiť chemoterapiou a ožarovaním, metastázy ostávajú vážnym problémov. Faktory podmieňujúce ich vznik zahŕňajú ako rôzne regulačné proteíny, tak aj určité miRNA. Spoločne spúšťajú migráciu rakovinových buniek a zabezpečujú im schopnosť prenikať cez steny ciev. Ich štúdiu sa venuje veľa úsilia a prvý väčší úspech prezentoval v časopise Nature Biotechnology R. A. Weinberg z MIT so svojimi spolupracovníkmi v apríli 2010.
Intravenóznym podávaním miR-10b antagomirov myšiam sa im podarilo výrazne znížiť množstvo cieľovej miRNA (miR-10b) v ich bunkách, čo v konečnom dôsledku viedlo k výraznému potlačeniu tvorby metastáz. MikroRNA miR-10b je zodpovedná za rozklad mRNA kódujúcej bielkovinu HOXD10 (obr. 3). Táto funguje ako regulátor prepisu niektorých génov s úlohou v bunkovej diferenciácii a vývoji organizmu a už dávnejšie bola popísaná jej rýchla strata v určitých nádorových bunkách. Zastavením rozkladu jej mRNA sa obnoví jej pôvodné množstvo, vďaka čomu bunky strácajú potenciál migrovať. Pôvodný nádor tým síce poškodený nie je, avšak samotné zastavenie vzniku metastáz je jedným z kľúčových krokov úspešného boja s touto chorobou.
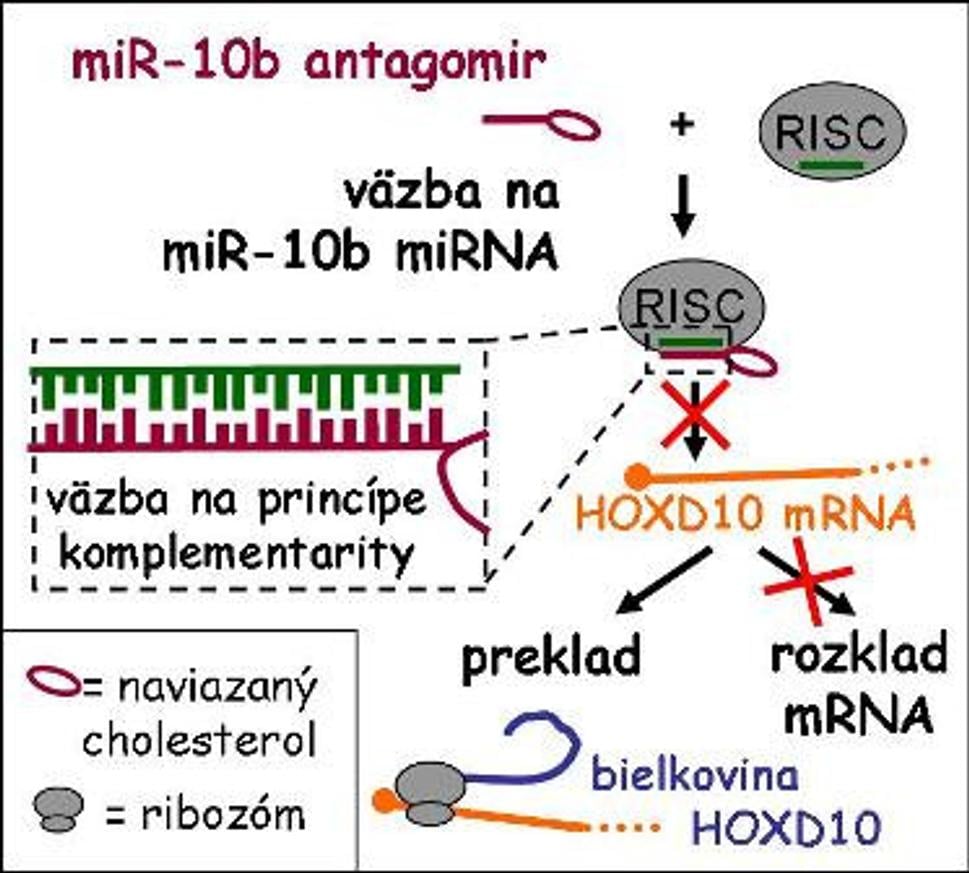
Obr. 3: Do bunky umelo vnesený antagomir sa naviaže na k nemu komplementárnu miRNA (v komplexe s RISC-om), táto preto nemôže sprostredkovať rozklad príslušnej mRNA. V konečnom dôsledku teda prepisom tejto RNA vzniká proteín, ktorý by bez zásahu antagomiru nevznikol (tu HOXD10).
Doterajšie pokusy na zvieratách naznačujú, že antagomiry sú dobre tolerované. Vďaka vysokej špecificite ich pôsobenia je predpokladané riziko vedľajších účinkov minimálne. Môžeme preto dúfať, že po množstve ďalších nevyhnutých pokusov sa "antagomirizácia", cielená inhibícia procesu RNA interferencie, stane bežnou súčasťou protirakovinovej liečby.






