Bunkové energeticko-metabolické centrá s vlastným genómom
Mitochondrie zabezpečujú väčšine našich buniek zásadnú časť tvorby hlavného zdroja metabolickej energie, adenozíntrifosfátu (ATP). Okrem toho sú sídlom mnohých ďalších reakcií, vrátane metabolizmu lipidov, vzniku nukleotidov (zložiek DNA), aminokyselín (zložiek proteínov), časti hému (v hemoglobíne) a iných látok. Udržiavajú oxidačno-redukčnú rovnováhu bunky, tvoria teplo a dôležitú úlohu zohrávajú i v priebehu bunkového cyklu, starnutí a programovanej bunkovej smrti.
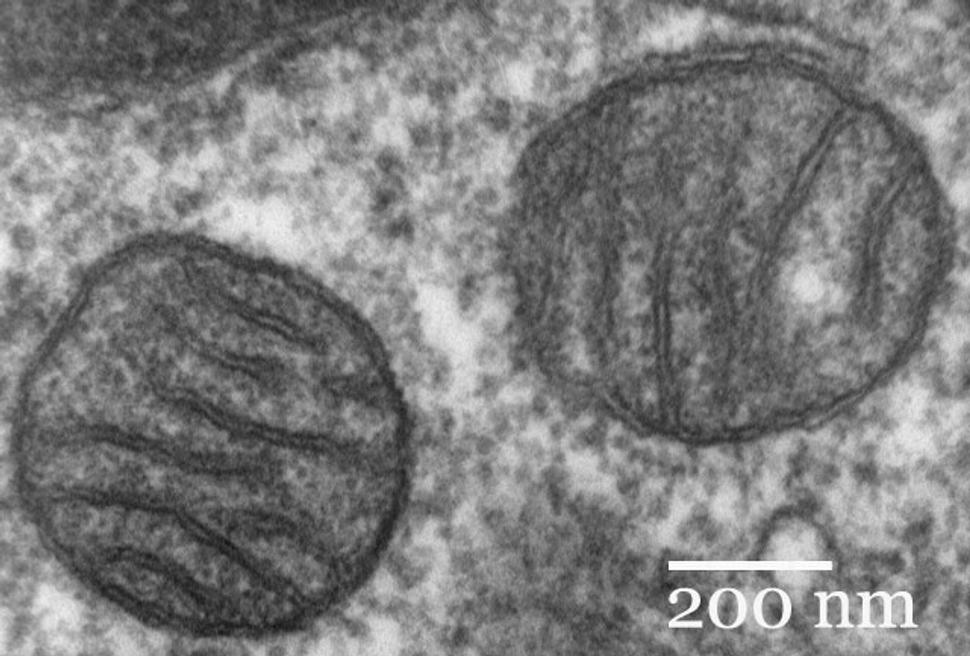
Prierez cicavčími mitochondriami zachytený pomocou elektrónového mikroskopu
Hoci väčšina genetickej informácie, ktorú zdedili po svojich evolučných bakteriálnych predkoch, sa počas 1,5-2 miliárd rokov vývoja presunula a integrovala do chromozómov jadra, ich fungovanie stále závisí aj od zvyšku génov, ktoré si nesú vo vlastnej DNA. Tieto gény kódujú malú časť proteínov zúčastňujúcich sa bunkového dýchania (čiže vzniku ATP a udržiavania oxidačno-redukčnej rovnováhy) a mnohé (transferové a ribozomálne) RNA nutné práve na vznik týchto proteínov (čiže na preklad mitochondriálnej genetickej informácie).
MtDNA sa, na rozdiel od jadrovej, nachádza v bunke v mnohých kópiách, vo vajíčku sa ich počet šplhá až k extrémnym 100 000. Vďaka tomu je pomerne vysoká šanca, že mutácie hoci aj viacerých kópií zároveň sa neprejavia. (Skutočný dopad takýchto poškodení na bunky a tkanivá však závisí od rôznych faktorov.) Pozoruhodné je, že organizmy dokážu svojmu potomstvu selektívne odovzdávať nepoškodené kópie mtDNA. Mechanizmus, ktorým odlíšia molekuly s chybami, je stále neznámy. O to viac prekvapili nedávne zistenia, že rôzne myšie orgány sa odlišne "bránia" súčasnej prítomnosti dvoch rôznych typov neporušených mtDNA [1].
Mitochondrie potrebujú jeden „zohraný set" génov
Pri génoch kódujúcich proteíny, ktoré vzájomne nespolupracujú či funkčne nesúvisia, sa zmena jedného neodrazí na jeho kombinovateľnosti s druhým. (Neexistuje napríklad dôvod, prečo by sme pri "zdedení modrých očí" museli zároveň "zdediť blond vlasy".) Naopak, selekčný tlak udržiavajúci počas evolúcie kompatibilné sekvencie je vysoký v prípade génov pre spolupracujúce proteíny, ktoré musia na vykonávanie funkcie napríklad "tvarovo do seba zapadať".
Variabilita sekvencií mitochondriálnych génov, odzrkadlená vo variabilite podôb nimi kódovaných proteínov (i RNA), je medzi jedincami (ľuďmi aj ostatnými stavovcami) vysoká. Tento poznatok už dávnejšie viedol k predpokladu, že keby sa v bunke stretli mitochondrie dvoch jedincov, ich proteíny by nedokázali dokonale spolupracovať, čo by viedlo najmä k poruchám bunkového dýchania. Treba si pritom uvedomiť, že obsah dvoch typov mitochondrií v jednej bunke by sa do istej miery premiešal, pretože sú to dynamické organely, podľa potreby sa spájajúce do trojrozmerných sietí a opätovne rozdeľujúce na mnohé menšie jednotky. Aj bez premiešania by však mohli nastať problémy, a to v prípade, že odlišné mitochondrie by za určitých okolností posielali iné signály bunkovému jadru a jeho (neraz možno "zmätená") reakcia by nemusela "vyhovovať" žiadnej z nich, čiže bunka by nebola vhodne prispôsobiteľná podmienkam. Komplikácie navyše by pravdepodobne spôsobovalo aj "evolučné súťaženie" medzi dvoma typmi mtDNA na úkor potrieb samotnej bunky.
Staršie pokusy s "miešaním mtDNA" spočívali vo vnesení malého množstva cudzej mtDNA do vajíčka a priniesli prakticky iba predstavu, že takáto genetická variabilita sa badateľne neprejaví a "náhodne" vymizne. Až nedávna príprava myší s dvoma typmi mtDNA v pomere 1:1 umožnila odhaliť, že organizmus sa takémuto "miešanému" stavu bráni aktívnym odstraňovaním jedného typu mtDNA (označme ho A) zo samičích zárodočných buniek [1]. Vďaka tomu ho už druhá generácia potomkov prakticky neobsahovala. Navyše v bunkách pankreasu a sleziny pôvodných "miešancov" kleslo množstvo typu A, zatiaľ čo pečeň a obličky si preferenčne udržiavali práve tento. Žiaden z použitých typov mtDNA (líšiacich sa zhruba 90 "písmenami") pritom nebol pre bunky problematický, ak sa v nich nachádzal sám. Mitochondrie jednotlivých tkanív sa navzájom líšia neraz až polovicou svojho proteínového zloženia (každý typ buniek má aktívnu inú časť génov), čo by mohlo spolu s rôznymi energetickými nárokmi či rýchlosťou obnovy tkanív súvisieť s ich rozdielnymi preferenciami pre jednu z prítomných mtDNA.
Vedcov tiež zaujalo, že nie každý orgán sa dokázal takto "brániť". Napríklad srdce, kostrové svaly, pľúca a mozog týchto myší si udržali pomer dvoch typov mtDNA zhruba 1:1 počas celého ich života. Z medzitkanivových rozdielov, ako aj z viacerých dopadov "zmiešaného" stavu na organizmus vyplynuli pozoruhodné hypotézy a nové pohľady na komunikáciu mitochondrií a jadra za rôznych podmienok [1, 2] (vzhľadom na zložitosť súvislostí sa ich opisu, žiaľ, vyhnem).
Zmes mtDNA v mozgu vedie k zmenám v správaní, učení a znášaní stresu
Keďže mutácie v mtDNA sú neraz spojené s poruchami správania, zmenami cirkadiánneho rytmu, chuti do jedla a spánkového cyklu, autori štúdie [1] sa zamerali práve na tieto aspekty. Myši so zmesou mtDNA nemali porušený cirkadiánny rytmus ani rozdielnu hmotnosť v porovnaní s kontrolnými skupinami. Za tmy (nezabudnime, že sú to nočné živočíchy) však oveľa menej prijímali potravu aj vydávali energiu (jej výdaj bol meraný ako pomer prijatého kyslíku a vydýchnutého oxidu uhličitého) a všeobecne boli skôr neaktívne.
V štandardných behaviorálnych testoch sa tiež správali odlišne. Počas núteného plávania, testu merajúceho tzv. "behaviorálne zúfalstvo", sa "uniknúť" snažili aktívnejšie a "zúfalstvu podľahli" až po dvojnásobnom čase. Ďalej napríklad v teste prirodzenej agorafóbie ostávali zhruba dvakrát dlhšie v centre neznámeho veľkého priestoru, vyvolávajúceho bežne u myší úzkosť. Ich adaptívny strach a úzkostlivosť boli teda výrazne znížené.
Možno to súvisí aj s ich správaním v tzv. Barnesovom bludisku, z ktorého vedci usúdili, že majú poruchy priestorového učenia a pamäte. Hoci sa boli tiež schopné naučiť nájsť úkryt rýchlejšie, ich učenie, priestorová orientácia a "stratégia úniku" boli výrazne horšie. S dňovým odstupom hľadali cestu von v priemere až štyrikrát dlhšie než myši s jediným typom mtDNA.

Barnesovo bludisko je tvorené kruhom s otvormi, z ktorých len jeden vedie do skrýše. Myš najskôr náhodne objaví skrýšu, v ďalších kolách sa už orientuje podľa predmetov umiestnených okolo kruhu, cestu z otvoreného priestoru vyvolávajúceho úzkosť teda nájde rýchlejšie. Tento test sa bežne používa na meranie účinku rôznych (potenciálnych) liečiv, mutácií alebo iných faktorov na orientačné schopnosti a pamäť.
Autori teda konštatovali, že hoci v pokoji boli málo aktívne, na stres a úzkosť takéto myši reagovali celkovo silnejšie, lenže táto zvýšená aktivita neprinášala výhodu vzhľadom na ich znížené schopnosti učenia a pamäte. Pozorované problémy boli pravdepodobne dôsledkom nedostatočnej "rezervnej" kapacity tvorby ATP vyplývajúcej zo "zmiešaného stavu" v mitochondriách mozgových buniek. Poukazuje to na možnosť, že aj relatívne drobný bioenergetický deficit by mohol zohrávať úlohu v ľudských psychických poruchách a ťažkostiach s učením [2].
Samce sú obeťou tzv. "materského prekliatia"
Minimálne časť problémov, ku ktorým by viedlo kombinovanie materskej a otcovskej mtDNA, je teda už aj experimentálne podložená. Z teórie genetiky však vyplývajú aj úskalia nastolené maternálnou dedičnosťou: Mutácie mitochondriálneho genómu môžu podliehať iba selekcii pôsobiacej priamo na samice, takže tie z nich, ktoré sú škodlivé iba pre samcov, nie sú odfiltrované evolučným sitom a hromadia sa. Pre túto situáciu vedci dokonca používajú pojem "materské prekliatie" (Mother's Curse). Po jeho presnej podobe a dôsledkoch však začali pátrať len nedávno, zatiaľ pokusmi na muške octomilke (Drosophila melanogaster).
Minulý rok boli publikované zistenia, že zatiaľ čo samice na drobné neškodné zmeny mtDNA reagovali prispôsobením expresie (čiže "miery aktivity") iba niekoľkých génov bunkového jadra, samce museli pozmeniť expresiu temer 10 % jadrových génov, najviac v reprodukčných orgánoch [3]. Takáto nutnosť komplikovaného prispôsobovania sa by sama o sebe problematická byť nemusela. Lenže tento rok pribudli informácie o tom, ako typ mtDNA ovplyvňuje nástup a priebeh starnutia drozofíl [4].
Tak ako v predošlej štúdii, vplyvy jadrových génov na rozdiely medzi jedincami vedci vylúčili tým, že bunkové jadrá mali všetky mušky rovnaké, dopady prostredia zase chovom za rovnakých podmienok. Tentoraz pripravili až trinásť typov octomiliek líšiacich sa iba mtDNA (tieto DNA pochádzali zo štandardných zdravých drozofíl z celého sveta). Miera pozorovaných rozdielov ich prekvapila. Zatiaľ čo dĺžka života a starnutie samíc s typom mtDNA korelovalo minimálne, odlišnosti medzi samcami, ktoré navyše celkovo starli rýchlejšie a zomierali mladšie, boli výrazné.
Sekvenovaním mitochondriálnych génov všetkých trinástich typov mtDNA autori zistili, že čím viac sa dve mtDNA líšili, tým viac sa líšil aj "profil starnutia" samcov mušiek, ktoré jednu z nich niesli. Genetické rozdiely boli pritom roztrúsené po mnohých génoch mtDNA. Zatiaľ čo na samice nemali badateľný negatívny dopad, selekcia, ktorá umožnila ich pretrvanie v populácii, "nezohľadňovala dostatočne potreby" samcov.
Už teda nie je len teoretickým predpokladom, že mtDNA kvôli svojmu čisto materskému pôvodu samce do istej miery znevýhodňuje. Podieľa sa dokonca zrejme na medzipohlavných rozdieloch v starnutí, a tie sú bežne pozorované u mnohých živočíšnych druhov.

Drosophila melanogaster
Mitochondrie - jeden z faktorov podnecujúcich vývoj dvoch pohlaví?
Aby sme neskončili takto "pochmúrne", pozrime sa ešte na súčasné predstavy o tom, načo sú vôbec, v prírode natoľko prevažujúce, dve rôzne pohlavia. Zatiaľ čo predstavy o výhodách (i nevýhodách) pohlavného spôsobu reprodukcie sú obšírne rozpracované, táto otázka uspokojivo zodpovedaná nebola. Vyššie spomínané zistenia o problémoch myší s dvoma typmi mtDNA však poskytli jeden z prvých experimentálnych podkladov podporujúcich, z celkom iného uhlu, len krátko pred nimi publikované výsledky matematického modelovania poukazujúce na úlohu mitochondrií v evolúcii odlišných pohlaví [5].
Zásadným genetickým rozdielom medzi pohlaviami je práve ich odlišný podiel na mimojadrovej (čiže u živočíchov mitochondriálnej) dedičnosti. Argumenty o škodlivom vplyve súťaženia dvoch mtDNA v jednej bunke nestačia na vysvetlenie dôležitosti tohto rozdielu. Vzhľadom na zložitú spoluprácu mitochondrií s jadrom je logické predpokladať, že práve evolučná selekcia v prospech koadaptácie jadrového a mitochondriálneho genómu by mohla podporovať dedenie mtDNA od jediného rodiča, a tým zvýhodňovať aj vývoj dvoch rôznych pohlaví.
Ako to neraz býva, biológovia sa kvôli preskúmaniu tejto hypotézy spojili s matematikmi. Zložitý matematický model, ktorý vytvorili pre prípad jednobunkového organizmu za rôznych podmienok, poukázal na pozitívny dopad dedenia mtDNA jediného rodiča na jej evolučnú koadaptáciu s jadrovou DNA, a tým aj na fitness organizmu. Vedci teda usúdili, že potreba takejto koadaptácie mohla byť dôležitou hybnou silou v evolúcii dvoch pohlaví [5]. Zistenia kolegov o nepriaznivom dopade "zmiešanej" mtDNA privítali ako nový rozmer v debate o tejto problematike [2].
___________
[1] MS Sharpley, C Marciniak, K Eckel-Mahan, M McManus, M Crimi, K Waymire, CS Lin, S Masubuchi, N Friend, M Koike, D Chalkia, G Macgregor, P Sassone-Corsi, and DC Wallace: Heteroplasmy of Mouse mtDNA Is Genetically Unstable and Results in Altered Behavior and Cognition. Cell, Oct 2012; 151(2): 333-43.
[2] N Lane: The problem with mixing mitochondria. Cell, Oct 2012; 151(2): 246-8.
[3] P Innocenti, EH Morrow, and DK Dowling: Experimental Evidence Supports a Sex-Specific Selective Sieve in Mitochondrial Genome Evolution. Science, May 2011; 332: 845 - 848.
[4] MF Camus, DJ Clancy, and DK Dowling: Mitochondria, Maternal Inheritance, and Male Aging. Current Biology September 2012; 22: 1717 - 1721.
[5] Z Hadjivasiliou, A Pomiankowski, RM Seymour, and N Lane: Selection for mitonuclear co-adaptation could favour the evolution of two sexes. Proc R Soc B, May 2012; 279: 1865 - 1872.






