Ako nám neustále potvrdzuje moderná veda, v prírode je veľmi veľa neintuitívneho a pri odhaľovaní mnohých tajomstiev zohrala úlohu náhoda. (Kto hľadá, nájde, hoci často niečo iné, než pôvodne hľadal.) Nie len preto, že základný výskum býva znevažovaný a obviňovaný z neužitočnosti, príklady toho, čo v dlhodobej perspektíve prináša, by si zaslúžili častejšiu, výraznejšiu propagáciu. Existuje dostatok kurióznych príbehov, mnohé sú však natoľko zložité po odbornej stránke, že ich popis laikom vyžaduje aj trpezlivého a zanieteného čitateľa. Zopár takýchto pútavých príbehov obsahovali i prednášky prof. Lukeša, na ktoré som sa rozhodla tu "zaspomínať".

Prof. RNDr. Július Lukeš, CSc. po pobytoch v Holandsku a Kalifornii pôsobí opäť na Parazitologickom ústave Českej akadémie vied v Českých Budějoviciach a vedie tiež Katedru molekulárnej biológie Juhočeskej univerzity. Medzi pracoviská, s ktorými roky spolupracuje, patrí aj jedno laboratórium Katedry biochémie PriF UK.
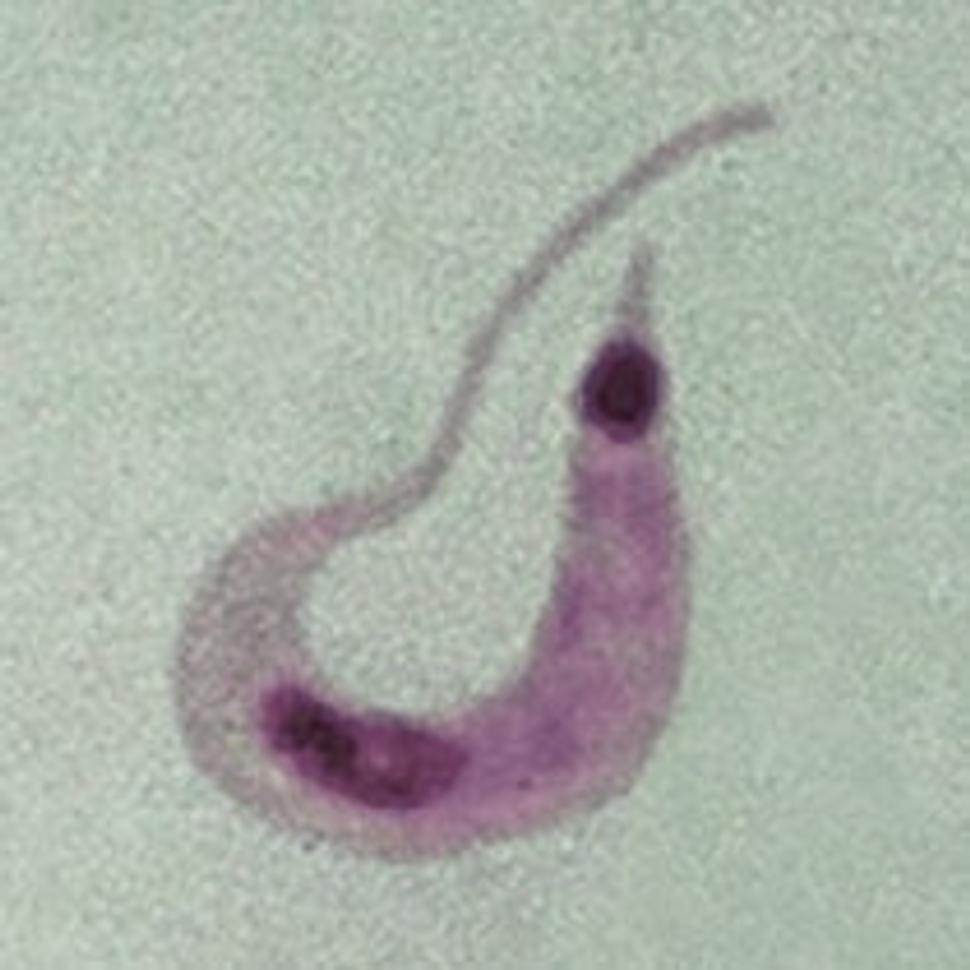
Svoju kariéru zasvätil bičíkatým prvokom, najmä trypanozomatídam. Mnohí zástupcovia tejto mimoriadne početnej skupiny organizmov sú nebezpečnými patogénmi človeka či zvierat, najznámejšie spôsobujú spavú chorobu (Trypanosoma brucei), Chagasovu chorobu (Trypanosoma cruzi) či leishmaniózu (Leishmania). Spavá choroba ohrozuje asi 60 miliónov ľudí v subsaharskej Afrike, leishmanióza postihuje odhadom 12 miliónov, Chagasova choroba 16-18 miliónov ľudí a neuveriteľným stovkám miliónov ľudí hrozí nakazenie.
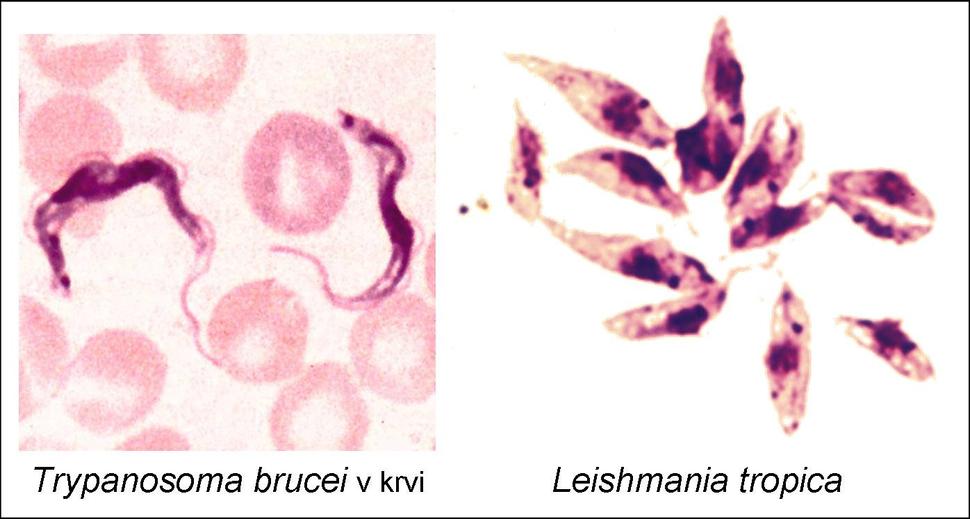
Trypanozómy a leishmánie však nie sú zaujímavé iba z medicínskeho hľadiska. Ich jedinečné organely a viaceré inde nevídané či zriedkavé bunkové procesy z nich robia fascinujúce modelové organizmy, ktorých výskum vniesol do biológie i principiálne nové pohľady. Prof. Lukeš sa roky venuje predovšetkým výskumu ich zvláštneho typu mitochondrie, tzv. kinetoplastu.
Mitochondrie väčšiny buniek sú miestom syntézy mnohých dôležitých metabolitov. Zväčša v nich tiež prebieha bunkové dýchanie (respirácia), čiže vysoko efektívna premena energie uschovanej v živinách na energiu vo forme, ktorú je bunka schopná univerzálne použiť vo väčšine procesov, teda vo forme molekuly adenozíntrifosfátu (ATP).
V bunke sa mitochondrií nachádza mnoho, nejde však o celkom samostatné organely, pretože tvoria dynamickú sieť. Tá sa v závislosti od podmienok rozpadáva a opäť spája do jedného či viacerých celkov. Sú zaujímavé aj tým, že obsahujú vlastnú genetickú výbavu, ako aj mechanizmy na jej udržiavanie a dekódovanie. Mitochondriálnym nosičom genetickej informácie je zväčša jedna lineárna alebo kružnicová molekula DNA, obsahujúca priemerne niekoľko desiatok tisíc "písmen" (dusíkatých báz) a vyskytujúca sa v desiatkach až stovkách kópií.
Kinetoplastidová DNA má mnoho zvláštností
Mitochondrie trypanozomatíd sú natoľko odlišné od práve načrtnutého "štandardu", že dostali i vlastný názov: kinetoplasty (odtiaľ názov skupiny organizmov Kinetoplastida). V jednej bunke sa nachádza jediná veľká organela, dokonca na konkrétnom mieste - pri "koreni" bičíku.
Nevšednou - z viacerých hľadísk - je však hlavne ich DNA. Vzhľadom na svoj tvar zvykne byť nazývaná kinetoplastový disk. Ten je tvorený malými a veľkými kružnicovými molekulami DNA, ktoré ako možno jediné v prírode netvoria typické priestorové štruktúry, tzv. nadzávitnice: Nie sú superšpiralizované, zato sú však navzájom zosieťované (katenované), podobne ako krúžky drôtu tvoriace drôtenú košeľu. Dokopy obsahujú až tisíce tisícov "písmen" (čiže tisíce kilobáz).
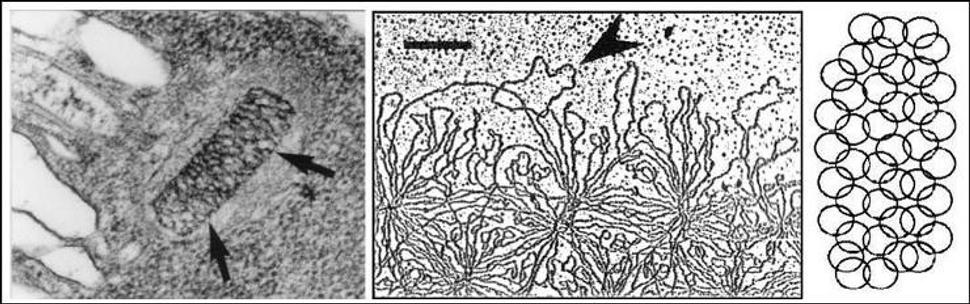
Pohľady z elektrónového mikroskopu: vľavo: Šípky ukazujú na kinetoplastový disk v bunke;
vpravo (väčšie priblíženie): Šípka ukazuje jednu dobre rozoznateľnú kružnicovú molekulu DNA, vedľa schéma spôsobu zosieťovania
zdroj: Lukes et al. (2002): Kinetoplast Structure: Evolution of an Improbably Structure;
Eukaryotic Cell 1(4): p497
Okolo kinetoplastového disku sú presným spôsobom zoskupené komplexy určitých proteínov. Tieto spoločne zabezpečujú, že sa pred delením bunky každá jedna molekula DNA skopíruje práve raz, že sa následne každý pár rozdelí medzi kinetoplast dcérskej a materskej bunky, ako aj že sa "kružnice" správne zosieťujú.
Dlho bolo záhadou, ako je možné v takej rôznorodej spleti "ustriehnuť", aby presne prebehli všetky tieto zložité procesy. Dnes je mechanizmus už pomerne detailne známy. Komplex proteínov nachádzajúci sa "pod" kinetoplastovým diskom po jednom "vyťahuje" zo siete molekuly DNA. Z každej sa štandardným mechanizmom vytvorí kópia a táto je inými proteínmi presunutá na jeden pól disku, zatiaľ čo jej materská molekula putuje na jeho opačný pól. Molekuly, ktoré už prešli replikáciou, sú "označkované": Obsahujú jednovláknové zlomy, ktoré na to určené proteíny zacelia až vtedy, keď sa ukončí replikácia všetkých DNA kinetoplastového disku. Na záver sú teda fyzicky oddelené materské a dcérske molekuly DNA, vďaka čomu už nie je potrebné ich triedenie počas delenia bunky.
Tajomstvo malých kružnicových molekúl bolo odhalené šťastnou "náhodou"
Napriek značnému množstvu DNA kinetoplasty obsahujú iba okolo 16 génov, z ktorých iba jeden je esenciálny pre prežitie bunky. (Funkcia ostatných je ale potrebná pre respiráciu, teda i prežitie v krvnom riečisku hostiteľa.) Na to, aby si trypanozomatídy tieto gény udržali, však potrebujú asi stovku proteínov kódovaných jadrovou DNA.
Nájdenie odpovede na otázku, ako "obhospodáriť" taký komplikovaný mitochondriálny nosič genetickej informácie, je síce náročnou, ale predovšetkým technickou záležitosťou, vyžadujúcou schopnosť správne formulovať jednotlivé podotázky a dizajnovať experimenty vedúce k ich zodpovedaniu. Odhalenie dôvodu, prečo existuje v bunkách trypanozomatíd niečo také zložité, vyžadujúce toľko špeciálnych, na energiu náročných mechanizmov, je však už na prvý pohľad iný typ problému. No aj ten možno rozdeliť na niekoľko aspektov.
Prvoradé a vlastne aj najjednoduchšie je zistiť, načo vlastne jednotlivé molekuly DNA v kinetoplastoch slúžia. Ako na to? V tomto prípade - jednom z výstižných príkladov milých prekvapení s veľkým dopadom, ktoré niekedy prináša základný výskum - zohrala úlohu náhoda. Hoci bolo známe, že väčšie "krúžky", všetky rovnaké, sú analogické "klasickým" mitochondriálnym genómom (čiže obsahujú gény pre niekoľko komponentov kinetoplastov), informačný obsah rozmanitých maličkých kružnicových DNA ostával záhadou.
Podľa rozprávania prof. Lukeša sa v istom laboratóriu pri štúdiu "celkom nezaujímavých" neškodných bičíkovcov žijúcich v muchách pozastavili nad "chybami" v sekvencii, ktoré sa pomerne často v kinetoplastovom genóme týchto prvokov vyskytovali. Odvaha bližšie sa venovať na pohľad "nepodareným" výsledkom a navrhnúť interpretáciu, ktorá sa neopiera o dosiaľ známe predstavy, priniesla úspech. Nesúlad sekvencie kinetoplastových proteínov s ich "predlohou" v DNA bol nakoniec vysvetlený existenciou mechanizmu nazvaného editovanie RNA.
Editovanie RNA odstraňuje "chyby", aby mohol vzniknúť funkčný proteín
Podobne ako pri editovaní textu, aj editovaním RNA sa "odstraňujú chyby", presnejšie dopĺňajú či vynechávajú "písmená" (bázy) tak, aby výsledný "text" dával zmysel, teda aby jeho preložením na kinetoplastových ribozómoch vznikol správny proteín. V prípade trypanozomatíd ide vždy o dopĺňanie či vynechávanie jedného alebo viacerých uridínov ("písmena U"), ktoré je často nevyhnutné pre vznik iniciačných a terminačných kodónov. Tieto sú interpunkčnými znamienkami určujúcimi začiatok resp. koniec úseku RNA, ktorý kóduje proteín.
Ako "oprava" prebieha a v čom spočíva úloha "malých krúžkov"? Tieto drobné DNA kódujú tzv. guide RNA (gRNA), ktoré obsahujú informáciu určujúcu, ako má vyzerať konečná, "bezchybná" sekvencia RNA. Jedna molekula RNA obsahuje zväčša veľa "chýb", a tak na to, aby bola editovaná, potrebuje niekoľko rôznych gRNA. Tieto k nej pristupujú postupne (od 3´ k 5´ koncu), vždy spolu s komplexom proteínov, tzv. editozómom, ktorý je priamym "vykonávateľom zmien". Editozómy sú niekoľkých typov: Keď gRNA "káže", aby sa z editovanej molekuly nejaké písmenká odstránili, editozóm musí obsahovať iné enzýmy, než v prípade, že je potrebné nejaké bázy pridať.
Okrem týchto enzýmov sa editovania RNA zúčastňujú aj rôzne pomocné proteíny. Viažu sa na gRNA, čím pozmenia jej štruktúru tak, aby bola schopná sa viazať na RNA, ktorá má byť podľa nej editovaná. Po nasadnutí editozómu pomocné proteíny odchádzajú a môžu sa naviazať na ďalšiu gRNA.
Načo je dobré mať "chyby" v DNA a editovať ich na úrovni RNA?
Keď už poznáme funkciu malých "krúžkov" DNA, je čas čeliť ďalšiemu aspektu ich nevšednej existencie. Tak ako v prípade ostatných biologických fenoménov, vyvstáva otázka, akú selekčnú výhodu poskytujú svojmu nositeľovi. Keďže trypanozomatídy divergovali zo spoločného predka pred asi 200-300 miliónmi rokov, proces editovania RNA sa objavil najneskôr v tom období. Ako je možné, že v priebehu evolúcie dávno nezanikol systém, ktorý jednak udržiava toľko "chýb" v DNA, jednak vyžaduje zložitý mechanizmus na ich odstraňovanie po prepise do RNA?
Je tu ešte jedna informácia, ktorá na prvý pohľad sťažuje odpoveď, v skutočnosti ju však našepkáva: Po editovaní je iba pomerne malá časť molekúl RNA (~10 %) skutočne "bezchybná"! Ostatné však obsahujú rôzne nenáhodné "chyby" a na rozdiel od väčšiny nesprávnych RNA, ktoré bunka rýchlo odstráni, tieto sú dokonca preložené do proteínov. To naznačuje, že ide o výhodnú variabilitu. Editovanie teda patrí medzi mechanizmy, ktoré umožňujú organizmu, aby vychádzajúc z istého počtu génov mohol vyrobiť väčšie množstvo rôznych typov proteínov.
Existencia takýchto mechanizmov vysvetľuje aj neočakávane nízky počet génov zložitých organizmov vrátane človeka. A hoci sa istý čas predpokladalo, že editovanie RNA je iba ďalším z množstva výnimočných javov charakterizujúcich trypanozomatídy, postupne ho vedci našli u mnohých iných organizmov, a to ako v mitochondriách, tak i v jadrách. Jeho mechanizmus je však často odlišný (napr. nezahŕňa gRNA, ale iba proteíny, prípadne spočíva v modifikácii dusíkatých báz).
Okrem možnosti kódovať jedným úsekom DNA viac než jeden proteín predstavuje tiež ďalší stupeň, v ktorom môže byť regulovaná expresia génov (čiže "prejavenie, realizácia" genetickej informácie). U človeka napríklad RNA kódujúca apoproteín B, súčasť lipoproteínových častíc (takých ako LDL či HDL), podlieha editovaniu regulovanému hladovaním. Jedno "písmenko" sa pri ňom zmení tak, že následne vzniká kratšia forma proteínu, ktorá má odlišnú funkciu v týchto časticiach, slúžiacich na prenos lipidov (vrátane cholesterolu) krvným riečiskom. Viacero štúdií tiež poukazuje na dôležitosť editovania RNA v bunkách nervového systému a pri ochrane voči parazitickým RNA vírusového pôvodu.
Dopady objavu editovania RNA
Editovanie RNA ako dovtedy neznámy proces by s veľmi vysokou pravdepodobnosťou v iných organizmoch než v trypanozomatídach objavené nebolo, pretože zatiaľ čo v týchto prvokoch "bije do očí", u ostatných buniek sa týka len mizivej časti RNA. Nie je to zďaleka jediný prípad, kedy štúdium zdanlivo výnimočného javu v zdanlivo nezaujímavom organizme prinieslo poznatky, ktoré viedli k záujmu hľadať a následne umožnili nájsť tento jav, hoci aj v odlišných podobách, v mnohých ďalších organizmoch, vrátane človeka.
Výskum editovania RNA je významný aj pre svoje medicínske implikácie. Keďže je nevyhnutné pre prežitie parazitujúcich trypanozomatíd v hostiteľovi, a zároveň je u nich vykonávané mašinériou, ktorá sa v živočíšnych bunkách nenachádza, predpokladá sa, že by mohlo byť vhodným terapeutickým terčom. Budúcnosť možno prinesie aj nové náhľady na jeho úlohy v ľudských bunkách a s nimi tiež predstavy o ich medicínskom využití.
(Text vznikol na základe časti mojich poznámok z prednášok prof. Júliusa Lukeša
v r. 2008 na Prírodovedeckej fakulte UK v BA.
Na editovanie a dôvody jeho zachovania počas evolúcie časom pribudli nové pohľady, niekedy sa o nich možno tiež zmienim...)






